
|
Читайте также: |
1. АТМОСФЕРА АЗОТЫН ФИКСАЦИЯЛАУ ӘДІСТЕРІ
Азотты фиксациялау – ауадағы молекулалық азотты өсімдіктерге сіңімтал, азоттың қосылыстарына ауыстыру. Табиғи жағдайда арнайы микроорганизмдердің көмегімен іске асады.
Атмосфера азотын фиксациялаудың негізгі үш түрлі техноллогиялық әдістері белгілі, олар:
1. Доға әдісі;
2. Цианамид әдісі;
3. Аммиак синтезі.
Әдістердің үшеуі ХХ-ғасырдың алғашқы жылдарында ұсынылған.
1.1. Доға әдісі табиғи құбылыстарға (найзағай) негізделіп ұсынылған. Жоғары температурада (3000-40000С) электр доғасы арқылы ауа ағыны өткенде инертті азот тотығады:
N2+O2Û2NO-181,4 кДж
Бұл процес қайтымды. Түзілген азот (ІІ) оксидінің шығымы 2% шамасында, температураны одан әрі жоғарылатқан сайын шығымы төмендей береді – азот (ІІ) оксидінің ыдырауы артады, температура төмендеген сайын азоттың тотығу жылдамдығы төмендейді. 1 т азотты тотықтыруға 60 000 квт.с электр энергиясы жұмсалады.
Доға әдісімен атмосферадағы азотты қосылыстарға айналдыратын (фиксациялау) зауыт 1901 ж терістік Америкада Ниагара сарқырамасының маңайында салынған, 1905 ж. Норвегияда осы әдіспен азот (ІІ) оксиді өндіріле бастады. Осы әдіс бойынша азот (ІІ) оксидінің шығымын арттыру үшін тотығу процесі кезінде түзілген газдар қоспасын жылдам суытып, азот (ІІ) оксидінің ыдырауын төмендетеді.Электр энергиясының тым көп мөлшерде жұмсалуына байланысты, бұл әдіс көрнекті түрде дами алмады.
Электр доғасы арқылы өткен ауа құрамындағы түзілген азот (ІІ) оксидін барботаж әдісімен әк суы мен оттектің қатысуымен кальций нитратына айналдырып, бөліп алған орынды.
4NO+3O2+2Ca(OH)2=2Ca(NO3)2+2H2O
1.2. Цианамид әдісі кальций карбидінің азотпен тікелей қосыла алатындығына негізделген.
Кальций карбиді, сөндірілмеген әк пен көмір (антрацит немесе кокс) қоспасын электр пешінде қыздыру әдісімен алынады. Карбидтің әр-бір тоннасын өндіргенде 2600-2900 квт.с электр энергиясы жұмсалады.
ұсатылған 1000-11000С температурадағы кальций карбиді арқылы ауадан бөліп алған азотты үрлейді, осы жағдайда жүретін химиялық реакция
CaC2+N2=CaCN2+C+302 кДж
Осылайша алынған кальций цианамиді - ұнтақ қатты зат, көмір араласқандықтан қара түсті. 0,6 МПа қысымдағы 110-1150С температурадағы су буын кальций цианамиді арқылы үрлегенде реакция нәтижесінде аммиак және кальций карбонаты түзіледі:
CaC2+3H2O=2NH3+CaCO3
Кальций циамидін өндіретін бірінші зауыт 1901 жылы Италияда салынып, 1905 жылдан бастап өндіріс мөлшерінде өндіре бастады.
1921 жылы цианамид өндірісі жылына 500 000 т цианамид өндіретін болды. Одан кейінгі уақытта жаңа зауыт салыну тоқтатылды, өйткені басқа әдіс табылып сол өріс алып кетті, ол - аммиак алудың техникалық әдісі. Аммиакты сутек пен азоттан синтездеу әдісі.
Цианамид әдісімен 1 т азотты фиксациялауға 12000 квт.с электр энергиясы жұмсалды.
1.3. Аммиак синтезі.
Азот пен сутек төменгі температурада қосыла алмайтын болғанымен, ол газдардың қоспасына электр ұшқынын жібергенде аммиак түзіле алатындығы ертеден белгілі болатын. Сен Клер Девилль 1864 жылы осы реакцияның егжей-тегжейін зерттеп, электр ұшқынын жіберу аммиак түзуге ғана емес, оның қайтадан азот пен сутекке айналуына да әсер ететіндігін анықтаған. Яғни азот пен сутектің арасындағы реакция қайтымды реакция және олар тепе-теңдік күйіне келеді:
N2+3H2Û2NH3
Электр ұшқынының әсерінен туатын жоғары температурадан тепе-теңдік солға қарай ығысады, сондықтан шығатын аммиактың мөлшері өте аз, соны өсіреміз деген талап көп уақыт іске аспай келеді.
ХХ-ғасырдың бас кезінде Нернст өз шәкірттерімен (Габер және Бош) ұзақ қажырлы еңбектерден кейін ғана бұл процесті зауыттық көлемде жүргізуге мүмкіншілік беретін жағдайын тапқан. Басты жағдай Лө-Шателье принципі бойынша қысымды көтергенде аммиактың шығымы көбеюуі керек, бұл тәжірибе жүзінде дәлелденді. Екінші жағынан, азот пен сутек қосылғанда жылу бөлініп шығатындығы анықталды:
N2+3H2Û2NH3+112 кДж (5000С және 30 МПа)
Демек неғұрлым температура жоғары болса, соғұрлым аммиак аз өндіріледі. Сондықтан реакция мүмкіншілігінше төменгі температурада өткізу керек. Бірақ төменгі температурада реакцияның жүру жылдамдығы өте баяу. Процесті тездету үшін катализатор жәрдемі керек болады, катализдік әсер тигізетін металдар аз емес, мысалы – маргенец, темір, родий, вольфрам, рений, осьмий, платина, уран және т.б. яғни d және f – ячейкалары толмаған элементтер. Осы элементтердің ішінен активтілігі ерекше жоғары төрт элементті айтуға болады: темір, осьмий, рений және уран, бірақ соңғы үш элемент бір жағынан қымбат, екінші жағынан өндірісте қауіпті. Қазіргі кезде өнеркәсіпте ең қолайлы катализатор-промоторланған темір. Промотор ретінде Al2O3; K2O; CaO және SiO2 қолданылады. Темір катализаторының активтілігін күкірт қосылыстары қайтымсыз бағытта төмендетсе, ал оттек, оттектің қосылыстары және көміртек (ІІ) оксиді қайтымды түрде уландыру нәтижесінде катализатор активтілігін төмендетеді.
Көп зерттеулерден кейін оңтайлы деп табылған жағдайдың бірі 20-100 МПа, 250-4500С. Соның өзінде аммиактың шығымы15-20%, түзілген аммиакты бөліп алу үшін газдар қоспасын салқындатып, аммиакты конденсациялайды, реакцияласып үлгермеген азот сутек қоспасын қажетті мөлшерде азот пен сутекті қосып процеске (синтез коллонасына) қайта жібереді (циркуляциялайды).
2. АММИАКТЫ СИНТЕЗДЕУДІҢ ФИЗИКА-ХИМИЯЛЫҚ НЕГІЗІ
Азот пен сутектің аммиакқа айналу дәрежесін 97%-ға жеткізуге 350 МПа қысым, 4000С температура қажет. Температура төмендеген сайын аммиактың тепе-теңдік шығымы артады, бірақ тепе-теңдік орнау жылдамдығы төмендейді. 4500С температурада 10 МПа қысымда аммиак шығымы 16 % болса, сол температурада 30 Мпа қысымда шығым 36% болады.
Азот пен сутек реакцияласу процесінің жылдамдығы азоттың активтілігіне тәуелді екені анықталған. Азотты активтеу энергия мөлшері тым жоғары, осыған байланысты реакция жылдамдығы өте төмен, аммиак шығымы аз мөлшерде болады. Азоттың активтеу энергиясын төмендету үшін катализатор қолданады.
 |
Мұнда К1 және К2 – солдан оңға қарай және оңнан солға қарай жүретін реакциялардың жылдамдылық константалары;
Р- газдардың парциалдық қысымдары;
a - 0 мен 1 аралығында өзгеретін, азоттың катализаторға адсорбциялау мөлшеріне тәуелді коэффициент.
b - Қысымның К1 және К2 әсерін тигізетін коэффициенті.
Егер a=0 болса
 |
 |
онда реакция солдан оңға қарай жүреді.
Аммиак шығымына температура және қысымнан басқа да көлемдік жылдамдық та әсер етеді (көлемдік жылдамдық өлшемі м3/м3×с). Көлемдік жылдамдықтың өзіне тиісті оңтайлы температурасы болады. Аммиак шығымы көлемдік жылдамдықпен кері байланыста, көлемдік жылдамдық көбейген сайын, аммиак шығымы төмендегеннен өндіріс өнімі артады. өндіріс өнімінің
 |
Мұнда: 0,77 – м3 аммиактың қалыпты жағдайдағы массасы.
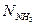 –газ қоспасындағы аммиактың моль саны
–газ қоспасындағы аммиактың моль саны
W – көлемдік жылдамдық
Көлемдік жылдамдық көбейген сайын оңтайлы температура жоғарылайды. Қазіргі кезде көпшілік өндіріс процестерінде қолданылатын көлемдік жылдамдық 40 000 С-1.
Аммиакты синтездеу әдістері технологиялық процесте қолданылатын қысымға байланысты үш түрге бөлінеді: 1) Төменгі қысымдағы – 10 МПа дейін қысым; 2) Орташа қысымдағы – 20-30 МПа; 3) Жоғары қысымдағы 75-100 МПа. Қазіргі кездегі көпшілік өндіріс орындарында аммиакты синтездеу процесі орташа қысымда жүргізіледі (20-30 МПа).
Аммиак шығымы 15-20% болғандықтан, алғашқы күйінде қалған азот және сутек қоспасы технологиялық процестің бас жағына қайта оралады (сұлба бойынша – “6”).
3. СИНТЕТИКАЛЫҚ АММИАК өНДІРУДІҢ СұЛБАСЫ
Аммиакты синтездеудің технологиялық процесі негізгі 7 операциядан құралады. Табиғи газ күкірт қосылыстарынан тазартылып (І) су буымен араласып (3,7:1), 800-8500С температурада никель катализаторларының қатысуымен конверсияланады (2), (9-10) мөлшерде алғашқы қалпында қалған метан су буымен араласып (0,8:1) шахты конвертиріне келіп 900-10000С температурада ауамен араласып, конверсия процесінің екінші сатысына ұшырайды (3). Шахты конверторынан шыққан газдың жылуын іске асыру мақсатпен, ыстық газды утилдеу қазанымен жанастырып 10 МПа қысымдағы 4800С температурадағы су буы алынады (4). Утилдеу қазанынан өткен газ 430-4700С температураға қыздырылған темір-хром катализаторы толтырылған конверторға келіп көміртек (ІІ) оксидінің конверсиялауының бірінші сатысына түседі, 2-4% мөлшерде қалған көміртек (ІІ) оксиді төменгі температурада (200-2600С мырыш-хром-мыс катализаторы толтырылған конвертор келіп (5) конверсиясының екінші сатысына түседі, сонғы конвертордан шыққан газ құрамындағы көміртек (ІІ) оксидінің қалдығы 0,2-0,4%-дан аспайды.
Конверсияланған газды СО2, СО және О2-ен тазартып, 30 МПА –дейін қысып, синтез құбырына жібереді. Аммиакты синтездеу құбырларындағы жылу-алмастыру арқылы (6) катализаторды 450-5000С дейін қыздырады. Синтез құбырынан шыққан аммиак-азот-сутек қоспаларынан аммиакты бөліп алу үшін су суытқышымен салқындатып аммиакты сұйық күйіне ауыстырып сеператорда бөліп алынады(7). Газ күйінде қалған аммиак, аммиак суытқышымен – 10-150С температураға суытылып азот-сутек қоспаларынан бөлінеді. Сұйық күйіндегі аммиак сол қалпында қоймаға жиналады. “Аммиак-синтез” құбырына ерекше төзімділік қасиеті бар хром-никель болатынан құйылған тұтас құймадан кеуектеу әдісімен тағайындалады. Бейнесі – цилиндр тәрізді, биіктігі 24 м, қабырғасының қалыңдығы 18 см, диаметрі 1,2-2,4 м. Синтез құбырының жоғарғы жартысына катализатор коропкасы (қорап), төменгі жартысына жылуауыстырғыш орналасқан. Құбыр корпусының құрамында мыс, көміртек болмауы міндетті. Себебі реагенттер құрамындағы сутек және синтезделінген аммиак технологиялық жағдайда агресивтік қасиетін көресетеді, яғни сутек гидрлеу процесіне: аммиак мыстың комплекс қосындыларының түзілуіне активті қатысып, синтездеу колонасы кеуектелініп, беріктілігін төмендетеді.

5 а – сурет. Орташа қысымда аммиакті синтездеуге арналған қондырғы сұлбасы: 1 - синтезду құбыры; 2 - су тоңазытқышы; 3 – газ бөлгіш; 4 - циркуляциялық соратпа; 7 – газ бөлгіш.

5 б – сурет. Орташа қысымда аммиакті синтездеу құбыры.
1 – коллона корпусы; 2 – қақпақтары; 3 – катализатор қорабы; 4 – жылу алмастырғыш; 5 - оңашаландыру (изоляция); 6 – желтартқыш тор;
7 – жылу алмастырғыш түтіктер; 8 – ортадағы түтік.
Дата добавления: 2015-09-03; просмотров: 859 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| СУТЕКТІ өНДІРУДІҢ ТЕХНОЛОГИЯЛЫҚ ӘДІСТЕРІ | | | АЗОТ ҚЫШҚЫЛЫН өНДІРУ |