
|
Читайте также: |
Химиялық реакциялардың жылдамдығын қарастыратын,физикалық химияның түрі—химиялық кинетика.
Белгілі уақыт аралығындағы химиялық реакция жылдамдығын келесі түрде анықтайды:
 , (1-29)
, (1-29)
Мұнда  —соңғы уақыт аралығындағы өнім концентрациясының өзгеруі.
—соңғы уақыт аралығындағы өнім концентрациясының өзгеруі.  . Формуладағы алу таңбасы бастапқы өнімнің концентрациясының кемуін, ал қосу таңбасы соңғы өнімнің концентрациясының өсуін көрсетеді.
. Формуладағы алу таңбасы бастапқы өнімнің концентрациясының кемуін, ал қосу таңбасы соңғы өнімнің концентрациясының өсуін көрсетеді.
Реакция даму барысында бастапқы өнім концентрациясы кемиді.Бұл массалар заңына сәйкес реакция жылдамдығын тежейді. Реакцияның жылдамдығы келесі ф ормуламен анықталады:
 . (1-30)
. (1-30)
Химиялық реакцияларға тек қабылдаушы өнім табиғаты емес, сонымен бірге қысым мен температура да әсер етеді. Химиялық кинетикада, химиялықөзгерісі мүмкін жоғары энергияға белсенді емес молекуланың көшуі- Белсенділік деп аталады. Белсенділік әдетте, молекулалардың қабырғамен, католизатормен, элементарь бөлшектермен соқтығысып, энергия алмасқан кезде болады. Химиялық өзгеріс болу үшін, бастапқы энергияның орташа кинетикалық эенргиясы салыстырмалы мәні болу керек. Бастапқы энергия- энергия және жылулық белсенділігі деп аталады.
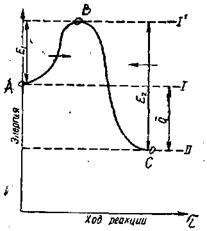
Реакция өтуіне энергетикалық шарттарды қарастырайық.(1-13).
Тура бағытта жүретін белсенділік энергиясын Е1, әрпімен, ал кері бағыттағыны Е2 әрпімен белгілейік. (1-1.сур)
Ал бастапқы өнімдер энергетикалық деңгейде болсын. Егер бастапқы өнімдер арасында белсенділік энергиясы Е1-ден кем емес молекула пайда болса, онда қабылдаушы жүйе потенциалды бөгетті орғып өтіп, экзотермиялық реакция өздігінен аяғына дейін жүреді. Бастапқы және соңғы қалыптық энергиялар айырмашылығықабылодағыш жүйенің жылу эффектісін құрайды.
Молекулалардың барлығы қабылдаушы болуы мүмкін емес, тек ерекше күйдегі молекулалар ғана осындай қасиетке ие. Белсенді молекулалар қарапайым эндотермиялық молекулалардан түзіледі. Химиялық өзгеріссіз молекула энергиясы өзгеретін үрдіс белсенділік деп аталады, ал белсенді молекула түзу кеіндегі жұтылатын жылу белсенділік жылуы деп аталады. Қарапайым және белсенді молекула арасында тепе-теңдік бар. Бұл тепе-теңдік тұрақтысы үлкен температуралық коэффицентке ие мән.
Қоспаның жағдайын анықтайтын тепе-теңдік тұрақтысы 
 .теңдеуіне тәуелді.
.теңдеуіне тәуелді.  ; сонымен бірге
; сонымен бірге  нәтижесі
нәтижесі  . Соңғы теңдеу жылдамдықтұрақтысының температурамен бірге өзгеруін келесі түрде көрсетеді:
. Соңғы теңдеу жылдамдықтұрақтысының температурамен бірге өзгеруін келесі түрде көрсетеді:
 .
.
Осылай температураның тепе-теңдіктен тәуелділігі арқылы біз Аррениус теңдеуіне келдік. Сонымен бірге реакция жылу эффектісі өнімнің белсенділік энергиясынан тәуелді екені шықты. Химиялық реакция бастапқы өнімнің молекулалары арасындағы химиялық байланыс үзілуінен пайда болады. Сондықтан жүйенің энергиясының бастапқы өлшемдерінен гөрі молекулалардың толық немесе жартылай бөлшектенуіне керекті энергия алдын ала есебі керек. Стехиометрлік теңдеулер нәтижесімен реакция реттілігі туралы айту қиын. Реакцияны зерттеу үшін оның кинетикалық теңдеуін және ретін білу керек. Жанудың химиялық реакциясы стехиометрлік теңдегу байланысты емес, радикал мен атом түріндегі аралық реакциялар арқылы өтеді.Реакция өтуіне белгілі бөгет болады, оны өту үшін белсенділік энергиясы керек. Инертті қоспа бар болса, реакция жылдамдығы баяулайды, нәтижесінде қабылдағыш заттардың концентрациясы төмендепЖанудың ең үлкен мәні стехиометрлік қоспаға келмейді, ал оны газ тәрізді және сұйық жанармай жану үрдісіннде басынан аяғына дейін болу керек. Қоспадағы үлес Е санының төмендеуіне байланысты, яғни инерттік қоспаның өсуіне байланысты  құрамы өзгереді.
құрамы өзгереді.

Реакция кері бағытта өту үшін, реакция өнімдеріне жылу эффектісінің өлшеміне жететін белсенділік энергиясы Е2-ге тең эенргетикалық бөгетті орғып өту керек.Мұндай реакция тек эндотермиялық болуы мүмкін, яғни қосымша жылу беру кезінде өтетін реакция.
Химиялық реакцияға әкелетін белсенді молекулалар соқтығысулар санын реакция жылдамдығының тұрақтысымен анықтауға болады.
ақырғысы температурамен байланысты:
 , (1-31)
, (1-31)
Осыдан
 . (1-32)
. (1-32)
 кезінде химиялық реакция жылдамдығының тұрақтысы
кезінде химиялық реакция жылдамдығының тұрақтысы  тогда:
тогда:
In k0 = const; (1-33)
 , (1-34)
, (1-34)
Мұннан
 , (1-35)
, (1-35)
мұнда Е —белсенділік энергиясы, кДж/(кг  моль); R — универсалды газдық тұрақты, к Дж/(кг • моль • К).
моль); R — универсалды газдық тұрақты, к Дж/(кг • моль • К).

|
|

|
 . (1-36)
. (1-36)
Соңғы теңдеу химиялық реакцияның жылдамдық тұрақтысы мен температура арасындағы байланысты орнатады және Аррениус заңынын математикалық мәні болады.
Ұзындық химиялық белсенді молекула санын мінездейді және реакция жылдамдығының тұрақтысының мәнін анықтайды.
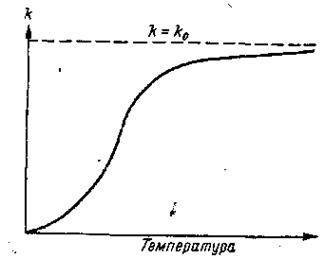
1-2 Суретінде (1-35) теңдеуіеде көрсетілген. Суреттен температура өскенде химиялық реакцияның жылдамдығы да өсетіні көрінеді.
1000К температурада реакция жылдамдығы кеміп, асимтоталық қисық абциссаның пареллель осіндегі түзуге ұмтылады. Аррениус заңына көп реакциялар бағынады, сонымен бірге жану реакциясы да кіреді.
(1-34) теңдеуі сызықтық болып мінезделеді. Ол жылдамдық тұрақтысының белсенді энергия мәнімен анықталатын түзу координатындағы температурадан тәуелділігін анықтайды.
Бұндай түрде тәжірибелік мәліметтерді қарастырғанда, белсенділік энергиясының мәнін анықтауға болады.
Жанармайдың әр түрінің белсенділік энергиясының шегі 8—16 МДж/(кг  моль) болады.Температура өзгерісімен химиялық реакция жылдамдығы белсендік энргиясы қанша есе өссе, сонша есе өзгереді. Молекулалық байланыс қарапайым болса, атомдық күйдегі заттарда белсендік энергиясы төмен. [12—25 кДж/(кг
моль) болады.Температура өзгерісімен химиялық реакция жылдамдығы белсендік энргиясы қанша есе өссе, сонша есе өзгереді. Молекулалық байланыс қарапайым болса, атомдық күйдегі заттарда белсендік энергиясы төмен. [12—25 кДж/(кг  моль)].
моль)].

Температуралары әртүрлі химиялық реакциялар жылдамдықтарын келесі ф ормуламен салыстыру керек:
 . (1-37)
. (1-37)
Химиялық реакция жылдамдығына сонымен бірге қысым да әсер етеді. р. Бұл тәуелділікті мына формуламен анықтауға болады:
 , (1-38)
, (1-38)
Мұнда  ,
, 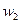 —қысымдағы реакция жылдамдығы
—қысымдағы реакция жылдамдығы  и
и 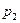 ; п — реакция реті
; п — реакция реті
Химиялық кинетикада реакция ретін дәреже көрсеткіші- деп атау керек.
Мысалы, бірінші ретін реакция жылдамдығы кинетикалық теңдеумен бейнелейді:
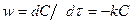 , (1-39)
, (1-39)
Екінші реттегі реакция теңдеуі:
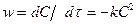 , (l-40)
, (l-40)
п- гореакция ретінің теңдеуі:
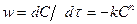 . (1-41)
. (1-41)
(1-38) теңдеуіне сәйкес бірінші реттегі реакцияға қысым әсер етпейді. Екінші реттегі реакция жылдамдығыбірінші дәрежелі қысымға пропорционалды,үшінші реттегі реакция—қысымның квадратына және т.б.
Көміртекті жанармайдың компоненттерінің жануы екінші реттегі реакцияға жатады. Демек, бұл реакциялар жылдамдығы қысымға пропорционалды.
Дата добавления: 2015-10-23; просмотров: 561 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Химиялық тепе-теңдік. | | | Жану реакциясының механизмі. |