
Для оценки качества природной воды обычно используют две характеристики - соленость и жесткость.
Под соленостью понимают общее содержание нелетучих растворимых веществ в воде. Величину солености устанавливают взвешиванием остатка после испарения одного литра исследуемой воды. Эта характеристика важна прежде всего при определении пригодности воды для питья, а также возможности ее использования в сельском хозяйстве и промышленности.
Жесткость связана с содержанием в воде растворимых солей двухвалентных металлов - кальция, магния, а иногда железа и марганца. Жесткая вода находит ограниченное применение в промышленности и быту. Так, в жесткой воде плохо заваривается чай, она непригодна для приготовления некоторых напитков; ее применение абсолютно недопустимо в технологии электронной техники; использование ее в паровых котлах и теплообменниках вызывает отложение накипи на стенках, что приводит к перерасходу топлива и разрушению металла. Коррозию металла усиливает гидролиз магниевых солей и солей железа, который сопровождается подкислением среды:
t
Mg2+ + 2H2O = Mg(OH)2 + 2H+;
t
Fe2+ + 2H2O = Fe(OH)2 + 2H+.
Величину жесткости воды определяют по содержанию в ней катионов кальция и магния, а иногда железа (II) и марганца (II) и обычно выражают в миллимолях на литр (ммоль/л). 1 ммоль/л соответствует содержанию в 1 л воды 40,08 мг ионов 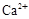 , или 24,31 мг ионов
, или 24,31 мг ионов 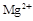 , или 55,85 мг ионов
, или 55,85 мг ионов  , или 54,94 мг ионов
, или 54,94 мг ионов  .
.
Рассчитать величину жесткости воды можно по формуле


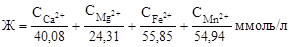 ,
,
где С в числителе - концентрация ионов металла, мг/л; числа в знаменателе - молярные массы соответствующего катиона металла.
Различают общую, временную и постоянную жесткость воды.
Общую жесткость воды обуславливают все растворимые соли кальция, магния, железа (II) и марганца (II).
Временная жесткость связана с наличием в воде растворимых гидрокарбонатов - 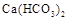 ,
, 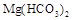 ,
, 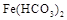 ,
, 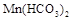 . Поэтому она также называется карбонатной. Временной ее называют потому, что она может быть почти полностью уcтранена кипячением воды. Именно временная жесткость воды является основной причиной образования накипи.
. Поэтому она также называется карбонатной. Временной ее называют потому, что она может быть почти полностью уcтранена кипячением воды. Именно временная жесткость воды является основной причиной образования накипи.
Постоянная жесткость связана с присутствием всех остальных растворимых солей кальция, магния, железа и марганца. Она не может быть устранена кипячением воды.
Происхождение жесткости воды объясняется прежде всего растворением природных минералов кальция и магния. В частности, карбонаты (известняки, мел, мрамор, доломит и др.), реагируя с растворенным в воде углекислым газом, образуют сравнительно хорошо растворимые гидрокарбонаты. Этот процесс можно представить следующим уравнением реакции:
MeCO3 + CO2 + H2O → Me(HCO3)2,
где Ме - это катион кальция или магния.
На равновесие в системе большое влияние оказывает изменение концентрации углекислого газа в воде. Если она возрастает, то равновесие смещается вправо, что сопровождается дополнительным растворением карбонатов. Если же концентрация углекислого газа уменьшается, то равновесие смещается влево, часть гидрокарбоната переходит в карбонат и выпадает в осадок.
Катионы железа попадают в воду чаще всего в результате коррозии железных труб и присутствуют в ней в виде гидрокарбоната железа (II).
Соли марганца (II) встречаются в подземных водах лишь некоторых районов, в которых сосредоточены металлургические и металлообрабатывающие предприятия (Кузбасс, Средний Урал). Их источником, как правило, являются сточные воды этих предприятий.
Жесткость природных вод колеблется в широких пределах. Вода с жесткостью менее 2 ммоль/л считается мягкой, от 2 до 3 ммоль/л - умеренно жесткой, от 3 до 4 ммоль/л - средней, от 4 до 6 ммоль/л - жесткой и более 6 ммоль/л - очень жесткой.
На практике определяют карбонатную Жк и общую Жо жесткость воды. Величину некарбонатной жесткости Жн можно рассчитать по формуле
Ж н = Жо − Жк.
В лаборатории для определения карбонатной жесткости воды применяют один из способов объемного анализа - титрование, которое в этом случае заключается в прибавлении к определенному объему воды до окончания реакции по каплям раствора соляной кислоты HCl известной концентрации. При этом содержащиеся в воде гидрокарбонаты кальция, магния, железа и марганца реагируют с кислотой по уравнению
Me(HCO3)2 + 2HCl = MeCl2 + 2H2O + 2CO2↑,
где Me - это Ca2+, Mg2+, Fe2+ или Mn2+.
Об окончании реакции судят по изменению окраски индикатора - метилового оранжевого: от желтой (щелочная реакция среды) до бледно-оранжевой.
Концентрацию раствора кислоты обычно выражают через нормальную концентрацию, что позволяет для расчета карбонатной жесткости воды применить закон эквивалентов
Жк =  , ммоль/л,
, ммоль/л,
где Vк - объем кислоты, затраченной на титрование, мл; Nк - нормальная концентрация кислоты, экв/л; Vводы - объем исследуемой воды, мл.
Определение общей жесткости воды также проводят титрованием определенного объема воды раствором комплексона - ЭДТА (комплексон III) известной концентрации.
ЭДТА представляет собой двунатриевую соль этилендиаминтетрауксусной кислоты. Эта соль образует прочные комплексные соединения с катионами металлов:
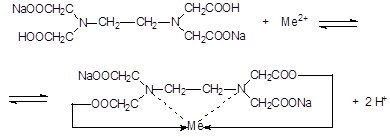
Сокращенно формулу ЭДТА обозначают Na2H2Y.
Точку эквивалентности при комплексонометрическом титровании определяют с помощью индикаторов-комплексообразователей (так называемых металлоиндикаторов), которые образуют с определяемыми катионами металлов окрашенные комплексные соединения, но менее прочные, чем комплексы тех же ионов с ЭДТА. Поэтому при титровании анализируемого раствора раствором ЭДТА ионы металла переходят от индикатора к комплексону и выделяется свободный индикатор, имеющий синюю окраску. Наиболее часто применяют эриохромовый черный Т (хромоген) и мурексид.
Анион индикатора хромогена, обозначаемый через HInd2-, имеет в щелочной среде синюю окраску. С катионами двухвалентных металлов он образует комплексы винно-красного цвета:
Ме2+ + HInd2‾ D MeInd– + H+.
синий винно-красный
При последующем титровании ЭДТА эти комплексы разрушаются и анионы индикатора переходят в раствор, сообщая ему синюю окраску:
MeInd‾ + [H2Y]2‾ = [MeY]2‾ + HInd2‾ + H+.
винно-красный ЭДТА бесцветный синий
Результат реакции ЭДТА с катионами кальция, магния, железа и марганца в большой степени зависит от рН среды. Оптимальной для данной реакции является слабощелочная среда, поэтому для создания и поддержания оптимального значения рН к исследуемому образцу добавляют аммиачную буферную смесь (NH4OH + NH4Cl), которая поддерживает постоянный рН = 9,2.
По объему и концентрации раствора ЭДТА, затраченного на титрование, вычисляют общую жесткость воды:
Жо = 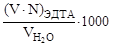 , ммоль/л.
, ммоль/л.
Процесс, приводящий к снижению жесткости воды, называется ее умягчением. Умягчение сводится к уменьшению концентрации солей, отвечающих за жесткость воды.
В настоящее время существуют термический, реагентные и ионообменный методы снижения жесткости воды.
Термический метод применяют для устранения временной жесткости воды. При кипячении воды происходит разложение гидрокарбонатов. Так, гидрокарбонат кальция при нагревании переходит в карбонат, который выпадает в осадок:

Карбонат магния в этих условиях обладает значительной растворимостью, поэтому в осадок выпадают менее растворимые основные соли и гидроксид магния:


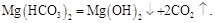
Еще более сложны превращения гидрокарбоната железа (II). Вследствие окисления железа (II) в железо (III) и полного гидролиза конечный продукт разложения представляет собой аквакомплекс гидроксида железа (III)  . Это соединение придает накипи желтовато-бурый цвет.
. Это соединение придает накипи желтовато-бурый цвет.
Временная жесткость воды может быть устранена также реагентными методами, например известковым. При этом методе к воде добавляют гашеную известь (гидроксид кальция) в количестве, необходимом для превращения кислых солей в средние. Так, гидрокарбонат кальция переходит в карбонат по реакции

Этот метод требует точной дозировки извести, так как ее избыток ухудшает качество воды.
Общей особенностью рассмотренных методов устранения карбонатной жесткости воды является удаление катионов металлов в виде малорастворимых осадков. Однако в этом случае в воде остается часть ионов, в первую очередь кальция, из-за растворимости осадков (раствор насыщен по иону кальция).
Концентрация катиона кальция в насыщенном растворе зависит от температуры и при 20 0С достигает 80 мг/л в пересчете на карбонат кальция. Поэтому предел снижения карбонатной жесткости  описанными методами составит величину
описанными методами составит величину
 ммоль/л.
ммоль/л.
Устранение постоянной, а также общей жесткости воды часто осуществляют реагентными методами, основанными на обменных реакциях, в ходе которых катионы кальция, магния, железа и марганца переходят в малорастворимые соединения и выпадают в осадок. Чаще всего для этой цели используют карбонат (содовый метод) или фосфат натрия (фосфатный метод). Следует отметить, что на практике эти реагенты обычно добавляют лишь после того, как устранены соли, вызывающие временную жесткость.
Большое распространение получил метод ионного обмена, при котором жесткость воды устраняется при ее фильтровании через слой твердого катионита - вещества, способного к обмену катионами с контактирующим с ним раствором. Чаще всего в качестве катионитов используются пермутиты, т.е. искусственные алюмосиликаты состава 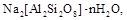 катионы натрия которых способны обмениваться на катионы, присутствующие в воде. Если схематически записать пермутит в виде Na2An, то обмен катионами между катионитом и водой можно выразить следующим уравнением реакции:
катионы натрия которых способны обмениваться на катионы, присутствующие в воде. Если схематически записать пермутит в виде Na2An, то обмен катионами между катионитом и водой можно выразить следующим уравнением реакции:
Me2+ + Na2An = MeAn + 2Na+.
Обмен ионов происходит в строго эквивалентных количествах и является обратимым. Поэтому отработанный катионит можно регенерировать, пропуская через него концентрированный раствор соли натрия (обычно NaCl).
Совместное использование катионита и анионита позволяет добиться полной деминерализации воды. Для этого воду сначала пропускают через слой катионита в H-форме (катионит, в составе которого подвижными являются катионы Н+, например высокомолекулярные сульфокислоты), а затем через слой анионита в ОН-форме (например высокомолекулярные амины). При этом происходит последовательный обмен катионов, содержащихся в воде, на Н+, а анионов - на  .
.
Таким образом, ионный обмен позволяет почти полностью обессолить природную воду. Полученная вода вполне заменяет дистиллированную воду и может быть использована для многих целей, например в атомных реакторах.
Дата добавления: 2015-10-26; просмотров: 290 | Нарушение авторских прав
| <== предыдущая страница | | | следующая страница ==> |
| Б) Осаждение хлоридом кальция . | | | Оборудование и реактивы |